¡Escribe tu textSÍMBOLOS Y FÓRMULAS QUÍMICAS
Desde el siglo pasado, los químicos usan letras mayúsculas, seguidas en ocasiones por una minúscula, para dar símbolo a un átomo o un elemento. Así, H significa un átomo de hidrógeno, o también el elemento hidrógeno.
C | carbono |
H | hidrógeno |
O | oxígeno |
N | nitrógeno |
P | fósforo |
S | azufre |
Los anteriores son los símbolos de los seis elementos constituyentes de todos los seres vivos
Los símbolos químicos provienen de palabras del latín. Por ejemplo, Fe viene de ferrum, la palabra latina para designar al hierro. El extraño símbolo del sodio, Na, viene del latínnatrium.
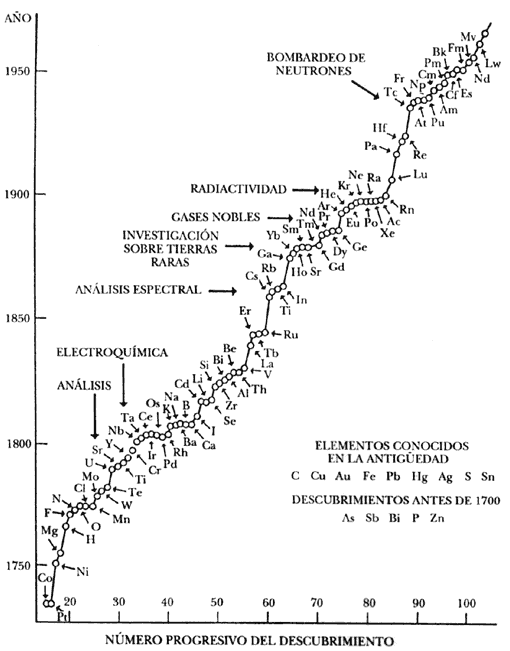
Figura 2. Cuadro cronológico del descubrimiento de los elementos químicos. Se citan también las técnicas que llevaron a los hallazgos. (Tomado de Cruz, Chamizo y Garritz, Estructura atómica. Un enfoque químico, Addison Wesley Iberoamericana Wilmington, 1986.)
Los átomos pueden formar agregados estables que caracterizan a todo material puro. Un tipo de agregado, las moléculas, contiene unos pocos átomos reunidos. Otros, por el contrario, están formados por enormes bloques de elementos repetidos que se encuentran enlazados, los llamados sólidos iónicos.
El número de combinaciones que pueden alcanzarse a partir de 92 elementos es impensable, de allí la diversidad de ellas en la naturaleza.
Para abreviar y referir a las sustancias puras con propiedad, el químico hace uso de fórmulas, expresando los elementos presentes y la proporción que existe en aquellas de cada uno de los átomos.
Cuando escribe «NaCl«, el químico habla de una sustancia que sólo contiene sodio y cloro, y que por cada átomo de sodio contiene uno de cloro. Sólo hay un compuesto con estas características: la sal común. Por otro lado, el bicarbonato de sodio que se empleaba para combatir las agruras tiene por fórmula NaHCO3, por lo cual debe entenderse que cada átomo de sodio viene acompañado de uno de hidrógeno, uno de carbono y tres de oxígeno.
EN EL MEXICO PREHISPÁNICO
Desde antes de la Conquista, los pobladores del valle de México sabían de la existencia y el aprovechamiento de las sales alcalinas. En tiempo de secas, estas sales afloraban a la superficie y formaban costras, que recibieron el nombre de tequixquitl o tequesquite. Sahagún cita que: «La tierra salitrosa se llama tequixquitlalli, que quiere decir tierra donde se hace el salitre.» El lago de Texcoco contiene 81% de sales, entre las que sobresale el carbonato de sodio, Na2CO3, con 45%, y el cloruro de sodio, NaCl, con 34 por ciento.
El comercio del tequesquite se hacía en Iztapalapa, nombre que significa «pueblo donde se recoge la sal» o ixtail. Así, en el nombre Ixtapan de la Sal se hace un uso redundante de dos lenguas.
Al añadir el tequesquite a la comida se condimentaba con sal y se facilitaba la cocción de las legumbres. También se lo empleó como detergente alcalinizante ligero.

Figura 3. El caracol. Las aguas del lago de Texcoco siguen siendo aprovechadas hoy para obtener carbonato de sodio. Como primer paso, la industria Sosa Texcoco emplea un enorme evaporador solar, ¡de 800 hectáreas!, Que concentra en sales las aguas extraídas del subsuelo. (foto tomada del artículo «un caracol gigante permanece activo», ICYT, núm. 136, enero de 1988, p.47. cortesía del ingeniero Alberto Urbina del Razo.)
LOS ÁCIDOS, LAS BASES Y LAS SALES
En química, como en todas las ciencias, se acostumbra efectuar clasificaciones. En este caso, lo que se clasifica son los tipos de sustancias puras conocidas. Existen unas —losácidos— con sabor agrio, que cuando se disuelven en agua liberan partículas llamadas iones hidrógeno (H+)
. Un ejemplo es el vinagre, que es una disolución de ácido acético en agua. Otras sustancias —las bases, también llamadas álcalis— tienen un sabor amargo y se sienten resbalosas al tacto. Al disolver una base en agua se reduce la proporción de iones hidrógeno. La leche de magnesia que tomamos contra la acidez estomacal es una base.
Se puede decidir si un compuesto es ácido o base gracias a sustancias especiales, llamadas indicadores,que cambian de color en función de la concentración de los iones hidrógeno presentes. Por ejemplo, el papel tornasol adquiere color rojo en presencia de un ácido, y azul frente a una base. Hasta un té negro cambia de color al añadirle unas gotas de limón, ¿verdad?
Ácidos y bases desempeñan un papel esencial en la química de nuestra vida diaria. Son ampliamente utilizados en diversos procesos de manufactura y de ellos depende, entre otras cosas, el correcto funcionamiento de nuestro cuerpo y el de todos los seres vivientes. Por ejemplo, la acidosis o la alcalosis de la sangre pueden provocar la muerte. Igualmente, la mayoría de las cosechas crecen sanamente en suelos ligeramente ácidos. De esta forma, del análisis que lleve a cabo y de las medidas que tome el químico agrícola, depende la productividad del suelo y, por lo tanto, la existencia de suficiente alimento.
Ambos tipos de compuestos se combinan, aniquilando uno al otro sus propiedades originales. El resultado es la formación de una sal. La sal común —NaCl, cloruro de sodio— se obtiene al combinar un ácido que contiene cloro (HCl, ácido clorhídrico) con una base que posee sodio (NaOH, hidróxido de sodio o sosa cáustica, que, por cierto, es común para las amas de casa, pues ¡es buena para destapar caños obstruidos!).
En el cuadro 1 se muestran los nombres de algunas sales con sus aplicaciones
CUADRO 1. Algunas sales y sus aplicaciones. | |
Nombre | Aplicaciones |
| Bicarbonato de sodio (polvo para hornear) | Antiácido |
| Bromuro de plata | Emulsiones fotográficas |
| Carbonato de sodio deshidratado (sosa de lavar) | Manufactura del vidrio; ablandador de agua |
| Cloruro de calcio | Para deshielo de calles y aceras en países frios |
| Cloruro de potasio | Sustituto de la sal, libre de sodio |
| Cloruro de sodio (sal de mesa) | Electrólito corporal; manufactura de cloro y sosa caústica |
| Fluoruro de sodio (fluorita) | Para obtener de derivados fluorados (el teflón de las sartenes, por ejemplo) |
| Ioduro de sodio | Se mezcla con la sal común para prevenir el bocio |
| Nitrato de plata | Agente cauterizante |
| Permanganato de potasio | Desinfectante y fungicida |
| Sulfato de aluminio y potasio (alumbre) | Industria del vidrio; pigmentos y tintorería |
| Sulfato de amonio | Fertilizante |
| Sulfato de bario | Estudios gastrointestinales; pigmento blanco |
| Sulfato de calcio dihidratado | Yeso para construcción |
| Sulfato de cobre pentahidratado (azul de vitriolo) | Tintura; fungicida |
| Sulfato de magnesio heptahidratado (sal de Epsom) | Purgante |
| Sulfato de sodio decahidratado (sal de Glauber) | Purgante |
| Tiosulfato de sodio | Agente fijador en el proceso fotográfico |
| Es característico de todas las sales formar cristales, que son la manifestación macroscópica del arreglo interno ordenado de sus átomos. | |
OTRAS SUSTANCIAS CONOCIDAS ANTES DE LA CONQUISTA
La sal común era apreciada por los antiguos mexicanos. Se dice que su carencia fue motivo de guerra entre aztecas y tlaxcaltecas.
Entre otras sales conocieron también el alumbre, la mica, el yeso y la calcita, con las que fabricaron colorantes, recubrieron muros y labraron columnas. Respecto a las piedras preciosas, trabajaron la turquesa, el jade, el azabache, el ojo de gato, el rubí y el ámbar. Los dignatarios aztecas usaban, en forma exclusiva, piedras preciosas verdes de fluorita (fluoruro de calcio), mineral del que México sigue siendo primer productor mundial.
El cristal de roca (cuarzo) fue bellamente trabajado en el México antiguo. En Monte Albán, Oaxaca, se encontraron copas, orejeras y cuentas de este material. Se piensa también que son mixtecas las calaveras de cristal de roca del Museo del Hombre en París y del Británico de Londres.
Su cerámica era poco técnica, pero muy artística. Los olleros de Tlaxcala, a juicio de Gómara, hacían tan buena loza como la que había en España. Un buen número de minerales servía para la elaboración de colores para pintura, especialmente los óxidos de hierro, el negro de humo y las arcillas mineralizadas. El color rojo que obtenían de la cochinilla (nocheztli), o sangre de tunas, fue exportado a todo el mundo por los españoles y utilizado durante siglos.
El barro y el adobe fueron materiales comunes de edificación en las más antiguas construcciones del valle de México (el cerro del Tepalcate y la pirámide de Cuicuilco). Los aztecas obtenían una especie de cemento al mezclar la cal con una arcilla negra. Por otra parte, los muros de las casas de Moctezuma estaban revestidos con jaspe, una variedad cristalina del cuarzo, de muy diversos colores.
CUADRO 2. Los metales en el México antiguo. | ||
Metal | Símbolo | Aplicaciones |
Oro | Au | Los mexicanos llamaban a este elemento teocuitlat(excremento de los dioses). Por su color y belleza era considerado el símbolo del Sol. Se extraía, por ejemplo, de los ríos de Oaxaca y Veracruz |
Plata | Ag | Fue utilizada para hacer adornos, tanto sagrados como para los nobles. Se la encontraba en estado nativo en las arenas de los ríos. No obstante, se explotaba en yacimientos de Pachuca, Taxco y Zumpango. Los objetos de plata abundaban en el mercado de la gran Tenochtitlan. |
Cobre | Cu | Tuvo múltiples usos. Los zapotecas lo incluían en monedas y hachas. Los mayas en cascabeles, como ornamento dedicado al dios de la muerte. Se han hallado palas de cobre de los agricultores aztecas. |
Estaño | Sn | Se obtenía y trabajaba en Taxco y se vendía en el mercado de Tenochtitlan. Del cenote sagrado de Chichén Itzá se extrajeron objetos de metal. |
Mercurio | Hg | Varios gramos de mercurio nativo se hallaron en una tumba maya en Copán (Honduras). Este metal fue conocido por los indígenas de Chilapa y, tal vez, por los de Temascaltepec (Estado de México). |
Plomo | Pb | A pesar de su poco uso, se le ha encontrado como parte de aleaciones. Se vendió en Tenochtitlan con el nombre de tenetztli(piedra de luna). |
Hierro | Fe | Lo conocieron por formar parte de meteoritos, y aparentemente no se utilizaba. |
Para construir armas emplearon el vidrio volcánico (obsidiana) y extraían diversas resinas (incluido el hule) que empleaban como pegamentos en la pintura y la medicina.
Los aztecas producían varios tipos de tejidos. El más común era el hequen, fabricado con las fibras de magueyes y agaves. La clase alta empleaba vestidos de algodón blanco. Hacían papel con la corteza del árbol amatl.
El azúcar, que obtenían por evaporación del aguamiel, la usaban en su alimentación, lo cual era un lujo en la Europa de aquella época. También conocían la fermentación, por medio de la cual fabricaban el pulque.
Respecto a los metales, los aztecas conocían los siete elementos de los alquimistas (oro, plata, cobre, estaño, mercurio, plomo y hierro; véase el cuadro 2). Se ha insistido en que sólo trabajaban los metales nativos, o sea que nunca alcanzaron la edad del hierro, ya que este metal lo encontraron únicamente en meteoritos. Sin embargo, según Humberto Estrada, un hacha hallada en Monte Albán, con 18% de hierro, prueba lo contrario.
La herbolaria se desarrolló enormemente en el México precortesiano. Los aztecas curaban sus males con plantas medicinales. En 1555, un médico indígena de Xochimilco, Martín de la Cruz, recopiló en un libro los medicamentos empleados por los mexicas (véase la figura 4). Este libro, con material gráfico excepcional, apareció en 1925 en la Biblioteca del Vaticano, después de siglos de aparente pérdida.

Figura 4. El libro sobre herbolaria medicinal mexicana de Martín de la Cruz es un importante legado para la botánica y la medicina tradicionales. Todavía en años recientes, su estudio permitió al grupo del doctor José Luis Mateos, en el IMSS, encontrar el principio activo del cihuapahtli o zoapatle. De la Cruz cita que este vegetal se empleaba para facilitar el parto. Las investigaciones ratificaron que el zoapatle contiene un poderoso ocitósico (provoca la contracción del útero). Toda la sabiduría contenida en este libro fue heredada por los químicos orgánicos mexicanos de este siglo, que han sobresalido en el terreno internacional con sus investigaciones sobre productos naturales. (Ilustración tomada de Elías Trabulse, Historia de la ciencia en México. Siglo XVI, FCE, 1983.)
LA QUÍMICA EN LA COLONIA
Cierto es que la llegada de los españoles alentó la producción en beneficio de la metrópoli, pero también rigió la formación y desarrollo de la Nueva España. Por muchos años se asentó aquí el liderazgo en diversas ramas de la mineralogía.
La primera industria original de nuestro país se creó en Pachuca en 1555, gracias al genio de Bartolomé de Medina. Su proceso de recuperación de la plata por amalgamación con mercurio ha sido calificado por Bargalló como «el mejor legado de Hispanoamérica a la metalurgia universal». La formación de la amalgama de los metales preciosos con el mercurio permite su extracción en frío, proceso mucho más barato que el de la fundición. Posteriormente, hacia 1758, este proceso metalúrgico fue modificado por el clérigo minero Juan Ordóñez y Montalvo, a partir de un método de amalgamación en caliente, desarrollado en Perú. Irónicamente, una misión alemana intentó introducir esta técnica en 1786 a México, indicando que acababa de ser descubierta en Austria por el barón De Born.
Un vasco, Fausto de Elhuyar, se encargó del Real Cuerpo de Minería de la Nueva España en 1792. Diez años antes había descubierto el elemento químico llamado hoy tungsteno, al que bautizó como wolframio (por eso su símbolo químico es W). Elhuyar fue el primer profesor de química en México. El libro de texto que empleaba era el Tratado elemental de química, (1789) de Antoine Laurent Lavoisier; el creador de la química moderna. Esta obra fue traducida al español, en México en 1797, un año antes que en España.
Dentro del Real Cuerpo de Minería, Andrés Manuel del Río destacó por su trabajo de análisis químico de minerales mexicanos. En 1801, como resultado del estudio de un mineral de Zimapán, Del Río descubrió un elemento químico más, al que llamó eritronio. Posteriormente lo convencieron de que había confundido al eritronio con el cromo (Cr), lo que resultó falso. El metal fue redescubierto en 1830 por Sefstrom, quien lo denominó vanadio (V), como lo conocemos hoy.
En realidad, la primera aportación americana a la tabla de los elementos fue el platino (Pt), que era conocido por los indígenas de Sudamérica y fue presentado al mundo científico en 1748. Salvo esta contribución prehispánica, el eritronio (vanadio) fue el primer elemento químico descubierto en América. Habrían de pasar 125 años para descubrir el siguiente, en un laboratorio de Estados Unidos.
METALES Y NO-METALES
Hacia mediados del siglo XIX, gracias al hallazgo de un buen número de elementos y a la aceptación que había logrado la teoría atómica de Dalton, surgió la llamada clasificación periódica de los elementos, realizada por Mendeleiev en 1869.
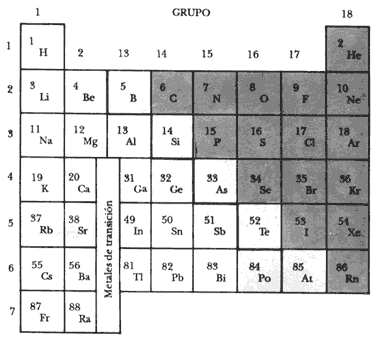
Figura 5. Tabla periódica corta. Los cuadros en blanco corresponden a los metales. El mexicano Del Río descubrió el metal de transición llamado hoy vanadio. Los no-metales se presentan con pantalla oscura. En la zona fronteriza (pantalla clara) están los elementos que presentan propiedades de ambos conjuntos: los elementos anfotéricos.
De acuerdo con la similitud de sus propiedades, los 92 elementos se arreglan en filas y columnas de la tabla periódica. En la parte izquierda e inferior de la tabla se encuentran losmetales y en la superior derecha los no-metales. Sus propiedades pueden consultarse en el cuadro 3.
CUADRO 3. Características de metales y no-metales. | ||
Propiedades | Metales | No-metales |
| Propiedades químicas: | ||
| Al reaccionar con agua, sus óxidos forman | Bases | Ácidos |
| Sus iones son generalmente | Positivos | Negativos |
| Propiedades físicas: | ||
| Apariencia | Brillantes | Opacos |
| Conducción del calor y la electricidad | Buenos conductores | Malos conductores |
| Deformaciones y rupturas de los sólidos | Pueden desformarse sin romperse | Quebradizos, se rompen fácilmente |
EL SIGLO XIX EN NUESTRO PAÍS
| Antes del movimiento de independencia, para ser precisos en 1803, recorrió México el ilustre barón alemán Alejandro de Humboldt, quien describió con lujo de detalle la vida y costumbres del México de aquella época. Respecto al comercio del jabón, que fuera introducido al país con la llegada de los españoles, menciona: En Puebla, México y Guadalajara, la fabricación de jabón sólido es objeto de comercio considerable. La primera de estas fábricas produce cerca de 200 000 arrobas al año [más de 17 000 kilogramos]. En la intendencia de Guadalajara se cuentan por el valor de 260 000 pesos. Favorece mucho a esta fabricación la abundancia de sosa, que se encuentra casi por todas partes en la meseta interior de México, a 2 000 o 2 500 metros. El tequesquite cubre la superficie del terreno sobre todo en el mes de octubre, en el valle de México, en las orillas de los lagos de Texcoco, de Zumpango y de San Cristóbal; en los llanos que rodean a la ciudad de Puebla; en los que se extienden desde Celaya hasta Guadalajara… Ignoramos si se debe su origen a la descomposición de las rocas volcánicas o a la acción lenta de la cal sobre la sal. En México, por 62 pesos se compran 1 500 arrobas de tierra tequesquitosa, una tierra arcillosa impregnada de mucho carbonato y de un poco de sal. Estas 1 500 arrobas, purificadas en las fábricas de jabón, dan 500 arrobas [43 kg.] de carbonato de sodio puro. |
Después de que Iturbide asumiera el poder, se creó la Sección de Farmacia dentro del Establecimiento de Ciencias Médicas. En ella laboró Leopoldo Río de la Loza, un mexicano ilustre que nació en la capital de la República en 1807. Allí obtuvo los títulos de cirujano y farmacéutico, y el diploma de médico. Es autor del primer tratado mexicano de química; que lleva el titulo de Introducción al estudio de la química (1849-1862).
Río de la Loza fue, por muchos años, profesor de química y estudió los productos naturales existentes en diversos vegetales mexicanos. En uno de ellos halló el ácido pipitzahoico, descubrimiento que lo hizo merecedor de un importante premio internacional. Fundó la Sociedad Farmacéutica, cuyo principal objetivo fue la edición de laFarmacopea Mexicana, que consta de multitud de sustancias y preparaciones curativas utilizadas en el país.
En esa misma época, cuando la química orgánica daba sus primeros balbuceos como ciencia, un mexicano llamado Vicente Ortigosa trabajó en Europa, donde aisló y analizó el alcaloide del tabaco, la nicotina, al que le dio la fórmula C10 H16 N2, a partir de los resultados del porcentaje presente de cada elemento:
C= 73.355%, H= 9.6% y N= 17.1%.
Los análisis más modernos informan la siguiente composición:
C= 74%, H= 8.7% y N= 17.3%.
Vemos que los resultados de Ortigosa son sumamente buenos para su época.
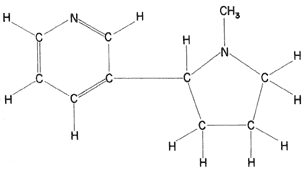
Fórmula 1. Fórmula desarrollada de la nicotina, el alcaloide del tabaco
A su regreso a México, Ortigosa no continuó con su trabajo, lo cual quizá se debió a una ausencia total de infraestructura para realizar investigación.
Gracias a la fundación del Instituto Médico Nacional, en 1888, se amplió la investigación de las plantas mexicanas y se analizó la posibilidad de fabricar medicamentos en gran escala.
QUÍMICA ORGÁNICA E INORGÁNICA
De forma muy general, se acepta que la química es el estudio de las sustancias, su estructura, su composición y las transformaciones en las que intervienen. Ahora bien, por razones históricas se acostumbra dividir las sustancias en dos grandes grupos: las orgánicas y las inorgánicas. De esta manera, tradicionalmente se ha hablado de la existencia de dos químicas, la orgánica y la inorgánica.
Aunque muchas sustancias orgánicas, como el azúcar, el vinagre o el alcohol, han sido conocidas desde la Antigüedad, fueron aisladas por primera vez en el siglo XVIII. En esa época, este tipo de compuestos se obtenía por la acción de los seres vivos. Por ejemplo, el ácido láctico fue aislado de la leche por Scheele (1742-1786), quien demostró que su presencia es la causa de que la leche se agrie. Juan Jacobo Berzelius propuso que los compuestos orgánicos sólo podían obtenerse por la acción de la fuerza vital y que por lo tanto existían dos tipos de compuestos en la naturaleza: los materiales inorgánicos, presentes aun en ausencia de vida, y los orgánicos, reservados para la materia animada.
Poco le iba a durar el gusto a Berzelius, pues en 1828 el químico alemán Federico Wöhler preparó urea (que se sabía era un producto de desperdicio de los seres vivos) a partir de una sal inorgánica llamada cianato de amonio.
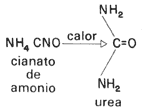
Fórmula 2. Reacción de Wöhler. Primera muestra de que no sólo dentro de los organismos vivos pueden realizar transformaciones de substancias inorgánicas en orgánicas.
A pesar de lo arbitrario de la clasificación, ésta persiste hasta nuestros días. Hoy se llama química orgánica a la relacionada con los compuestos que contienen carbono (salvo algunas excepciones, como los óxidos de carbono o los carbonatos). Como veremos en el siguiente capíptulo, el carbono es un elemento peculiar. Existen tantos compuestos de carbono que conviene estudiarlos en paquete. No obstante, hay que subrayar que la química es única. Los compuestos orgánicos e inorgánicos también reaccionan entre sí. Una rama moderna de la química, la organometálica, se encarga del estudio de un tipo de compuestos que no podríamos clasificar dentro de ninguna de las dos químicas tradicionales.
LA CREACIÓN DE LA PRIMERA ESCUELA DE QUÍMICA
Durante este siglo, la ciencia central ha prosperado notablemente en México. Sin embargo, su desarrollo no ha sido espectacular, sino más bien moderado. Tal vez sea la más rezagada de las ciencias básicas.
A principios de siglo, la incipiente industria se reducía a la producción cervecera, minera, de azúcar, de hilados y tejidos, así como de algunos productos farmacéuticos. El pavoroso dato de un 80% de analfabetismo en el país reflejaba el atraso cultural e intelectual generalizado. La fuga de técnicos extranjeros, debida al inicio del movimiento revolucionario y a la primera Guerra Mundial, marcaba la urgente necesidad de formación de personal especializado.
Desde luego, poco puede prosperar una ciencia sin la existencia de un semillero de científicos y técnicos. Para la química, esta fecha llegó en septiembre de 1916. Por iniciativa de don Juan Salvador Agraz, a la mitad del movimiento revolucionario se creó la Escuela Nacional de Química Industrial (hoy Facultad de Química), que en febrero de 1917 se incorporó a la UNAM.
La idea de Agraz era «instalar los cursos de peritos químicos industriales […] obreros químicos y pequeños industriales, y a los ingenieros químicos y doctores en química». Este último programa no pudo arrancar sino décadas después, pero hay que destacar que Agraz fue un gran visionario que apreció la necesidad de complementar la formación de profesionales con la de investigadores químicos. Ésta es la manera correcta de formar personal técnico que vaya más allá de la simple actitud imitativa y dependiente. Fue una desdicha que, por falta de fondos, el doctorado no haya podido iniciarse entonces.
Hacia 1919 se anexa a la Escuela la carrera de farmacia, que hasta entonces se realizaba en la Escuela Nacional de Medicina. Pronto se crearon los laboratorios de análisis y el de preparación de productos químicos orgánicos e inorgánicos. Además, se instaló una planta de éter y se levantaron nuevos edificios destinados a las industrias orgánicas de fermentación, azúcares y almidones, tanantes y curtientes, y farmacéutica.
LOS PRIMEROS BECARIOS
Cuando José Vasconcelos ocupó la Secretaría de Educación Pública surgió la iniciativa de becar a los mejores alumnos para realizar estudios complementarios en Europa. Así, por acuerdo de la Presidencia, en 1921 se otorgaron las primeras diez becas para estudiar en diferentes universidades alemanas.
Durante la estancia de estos primeros becarios mexicanos de la química ocurrió en Alemania un hecho sin precedentes: la gran inflación. Mientras que en febrero de 1922 un dólar se cambiaba por 300 marcos, hacia mediados de 1923 el dólar llegó a valer cuatro billones de marcos. ¡Y resulta que las becas se pagaban en dólares! Antes de esta inflación, con menos de la décima parte de la beca se cubrían todos los gastos de estancia. Se cuenta que uno de aquellos becarios, Fernando Orozco (luego director de la Escuela y del Instituto de Química), vivía en un ala de un elegantísimo castillo alemán. ¡Qué contraste con los becarios de décadas más tarde!
Hacia 1924 estudiaban becados en Europa un total de 22 estudiantes mexicanos de química. Al año siguiente, casi todos regresaron al país en busca de un lugar donde aplicar los conocimientos adquiridos. Se encontraron con una ausencia total de la infraestructura necesaria para realizar investigación. Algunos se colocaron en industrias, a las que dieron una importante renovación; otros participaron de cerca en el desarrollo de la Escuela — que llevaba entonces el nombre de Escuela Nacional de Ciencias Químicas— y habrían de desempeñar un papel importante en su consolidación. Tal vez quien más sobresalió entre ellos fue el mismo Fernando Orozco que residió durante sus estudios en aquel castillo. Orozco, doctorado en la Universidad de Hamburgo en análisis inorgánico de metales, promovió la actualización de los planes de estudio y fue de los asesores de PEMEX que hicieron posible la producción del antidetonante de las gasolinas inmediatamente después de la expropiación, tema en el que profundizamos en el segundo capítulo.
Casi veinte años después de que se fundó la Escuela de Química se creó el Instituto Politécnico Nacional, y en él la Escuela Superior de Ingeniería Química e Industrias Extractivas.
En 1941 se creó en la UNAM el Instituto de Química, con fondos provenientes de la Casa de España y del Banco de México. El Instituto vino a llenar el vacío de investigación química que existió durante muchos años e hizo realidad el inicio de la formación de científicos de esta área en México. Su primer director fue don Antonio Madinaveitia, uno de los refugiados españoles que México acogió después de la guerra civil. Don Antonio participó también en el diseño del proceso que hizo factible el aprovechamiento de las aguas del lago de Texcoco para la fabricación de sosa cáustica y carbonato de sodio. Esta moderna tecnología del tequesquite se implantó en la empresa Sosa Texcoco en 1942.
Como relatamos más adelante, la especialidad del Instituto fue la química orgánica. En el año de 1947 se graduó allí el primer doctor formado en el Instituto. Se trataba de Alberto Sandoval Landázuri, quien luego lo dirigiría por dieciocho años. Otro egresado conspicuo de esos años fue José F. Herrán Arellano, quien fundó y fue primer director de la División de Estudios Superiores, hecho por el que la Escuela Nacional de Ciencias Químicas se transformó en la hoy Facultad de Química de la UNAM
Aunque han sido diversas y muy amplias las aportaciones de la química mexicana en este siglo, a manera de ejemplo relatamos a continuación cuatro de ellas.
LOS ANTICONCEPTIVOS ORALES Y LA CORTISONA
En la misma década de su fundación, el Instituto de Química habría de coparticipar en uno de los descubrimientos modernos más sobresalientes: la píldora anticonceptiva.
La historia empieza en 1943, cuando el estadounidense Marker descubre en México un vegetal, llamado «cabeza de negro», con alto contenido de diosgenina, una sustancia que Marker sabía transformar en progesterona (compuesto de la familia de los esteroides). Esta hormona es segregada por las mujeres durante el embarazo, lo cual inhibe la menstruación. Para industrializar su descubrimiento, Marker se asoció con dos mexicanos, Somlo y Lehmann, y creó la empresa Syntex.

Figura 6. «La cabeza de negro» es un vegetal mexicano de raíz tuberosa que sirvió de materia prima para fabricar progesterona en los años cuarenta. Anteriormente, un gramo de esta sustancia costaba unos doscientos dólares. Cinco años más tarde, por los trabajos desarrollados en México, costaba sólo dos dólares. (Tomada del libro Una corporación, una molécula, Syntex, México, 1964.)
El éxito académico y comercial que tuvo la producción de hormonas en México fue espectacular. Hacia 1959, los científicos de Syntex habían publicado más artículos sobre esteroides que cualquier otra institución académica o industrial en el mundo. En cuestión de diez años, nuestro país, del que no constaba previamente ninguna contribución notable en química básica, se había transformado en uno de los centros mundiales de una rama especializada de la química orgánica.
Nos visitaron los más renombrados investigadores del mundo y se formaron en México importantes grupos de científicos.
Tal vez la labor más sobresaliente fue la del hidrocálido Jesús Romo Armería, investigador del Instituto de Química y de Syntex, quien participó en diversos proyectos de síntesis a partir de progesterona, los que culminaron en 1951 con la síntesis de la cortisona, que contiene tres átomos de oxígeno más, en posiciones cruciales, que la convierten en un eficaz antiinflamatorio y antiartrítico.
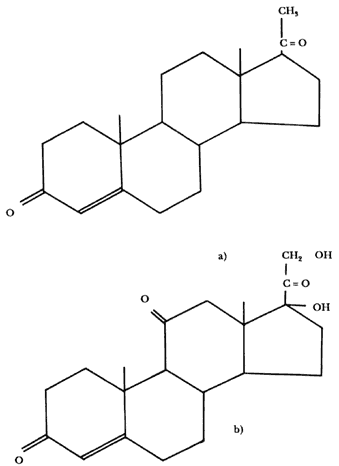
Fórmula 3. Si la posición de uno o más átomos difiere de una molécula a otra, las propiedades de las sustancias pueden variar enormemente. Las fórmulas están escritas en una especie de taquigrafíaquímica en la que se sobrentiende que en cada vértice existe un átomo de carbono con los hidrógenos necesarios. A) Fórmula molecular de la progesterona, la hormona del embarazo. B) Fórmula molecular de la cortisona, un potente antiinflamatorio.
Pocos años más tarde se produjeron en México los primeros antiovulatorios orales, que impiden que el óvulo abandone el ovario e interfieren por lo tanto en la gestación. Cinco años después, millones de mujeres en todo el mundo los estaban utilizando. Actualmente hay muy diversos tipos de antiovulatorios y sigue estudiándose cómo establecer la inocuidad de su empleo prolongado.
Por otra parte, Syntex fue vendida a una compañía estadounidense y se transformó en una corporación internacional. Hoy alcanza ventas anuales por más de mil millones de dólares. El centro de sus operaciones administrativas, de mercado y de investigación se ubicó en Palo Alto, California. En México continuó la fabricación de productos esteroidales intermedios, mientras que la de productos terminados se desplazó a Puerto Rico y las Bahamas.
EL INSTITUTO MEXICANO DEL PETRÓLEO
A raíz de la nacionalización del petróleo en 1938, las compañías extranjeras negaron la venta de tetraetilo de plomo (antidetonante de la gasolina, véase el capítulo II).
Pb (C2H5)4
Fórmula 4. Tetraetilo de plomo. Aunque mejora el desempeño de las gasolinas, la presencia de plomo en este compuesto es un agente grave de contaminación. La mayoría de los metales pesados son tóxicos para los humanos.
Después de un primer intento fallido, los ingenieros químicos mexicanos lograron, con la tenacidad que inspiran los bloqueos, echar a andar una planta de tetraetilo que se instaló en el mismo lugar donde 27 años más tarde (1966) se crearía el IMP.
México no sólo es el quinto productor de petróleo crudo en el mundo, sino también el decimosegundo de productos petroquímicos. Hacia 1982 se encontraba entre los primeros cinco por el número de plantas en desarrollo, situación que empeoró debido a la escasa inversión de los años críticos posteriores.
En el Instituto se han diseñado cerca de 100 plantas petroquímicas y de refinación de petróleo. Sin embargo, no todo ha sido diseño. El IMP cuenta con más de 150 patentes con registro internacional, entre las que destacan las de procesos de hidrodesulfuración (eliminación del contaminante azufre de las gasolinas y el diesel) y de desmetalización selectiva de residuos pesados (conocido como proceso DEMEX), con plantas que trabajan en el país y el extranjero.
El aporte del Instituto al desarrollo nacional ha sido muy importante. En fecha reciente concluyó, por ejemplo, el estudio global de la calidad del aire en la zona metropolitana de la ciudad de México, que permite simular y valorar el efecto que sobre la contaminación por azufre, hidrocarburos, óxidos de nitrógeno y ozono, tendría la aplicación de diversas medidas de control tales como algunos cambios en la composición de gasolinas y diésel, el efecto de las fuentes móviles y fijas, la eliminación de la refinería de Azcapotzalco, etcétera.
EL HIERRO ESPONJA
Tal vez la tecnología mexicana más conocida en el extranjero sea la que desarrolló la compañía Hojalata y Lámina (HYLSA) de Monterrey, respecto al llamado hierro esponja. Sobre dicha tecnología se informa en la Encyclopedia of Chemical Technology.
En 1957, un efecto de la guerra de Corea fue la elevación de los precios de la chatarra.HYLSA, que producía aeroplanos a partir de chatarra, hubo de iniciar un programa de investigación cuyo resultado fue el proceso de reducción directa del mineral de hierro. Una tecnología tercermundista de primera línea.
Treinta años más tarde, cuando la producción mundial de hierro alcanza los mil millones de toneladas, la tecnología de HYLSA sigue siendo líder en el campo de obtención de hierro por reducción directa.

Figura 7. Aspecto del hierro esponja, mineral de hierro después de ser sometido al tratamiento de reducción directa (cortesía del doctor Gabriel Gojon, UANL.)
REDUCCIÓN Y OXIDACIÓN, PILARES DE LA QUÍMICA
El término oxidación se aplicó originalmente a la ganancia de oxígeno en un cambio químico. La formación de herrumbre a partir de hierro es una oxidación, lo mismo que cualquier combustión. Al proceso inverso, la pérdida de oxígeno, se lo llamó reducción.
Posteriormente, ambos términos fueron ampliados para incluir la ganancia o pérdida de hidrógeno o electrones (véase el cuadro 4).
CUADRO 4. Significado de oxidación y reducción | |
Se oxida la sustancia o el átomo que | Se reduce la sustancia o el átomo que |
Gana oxígeno o pierde hidrógeno o pierde electrones | Pierde oxígeno o gana hidrógeno o gana electrones |
En el proceso del hierro esponja, la proporción de oxígeno que se encuentra combinada químicamente con el hierro en el mineral se va reduciendo paulatinamente gracias a la acción de una mezcla de hidrógeno (H2)
Y monóxido de carbono (CO)
, que se alimenta a800° C.
Ambas sustancias toman átomos de oxígeno del mineral (se oxidan) para formar H2O y CO2.
De esta manera, el óxido de hierro del mineral, Fe2 O3 se convierte en Fe3 O4, luego en FeO y finalmente en el elemento Fe. Es decir, el mineral de hierro se reduce (pierde oxígeno). El resultado es un hierro poroso, esencialmente con la misma forma y tamaño que la partícula del mineral, que es una magnífica carga para la elaboración de acero en un horno eléctrico, pues está libre de impurezas metálicas, es fácil de manejar y transportar y posee una composición química uniforme y precisa.
LA REVOLUCIÓN VERDE
En México se inició y desarrolló el proceso conocido como revolución verde, el cual permitió a Norman Borlaug ganar el Premio Nobel de la Paz de 1970, por sus descubrimientos en el campo de la agricultura.
Este proyecto, con influencia política pero esencialmente biológico y bioquímico, revolucionó la producción agrícola e influyó en la consolidación de importantes grupos mexicanos de investigación, como el del Centro Internacional para el Mejoramiento del Maíz y del Trigo (CIMMYT), el del Instituto Nacional de Investigaciones Agrícolas (INIA) y el del Colegio de Posgraduados de Chapingo.
En veinte años, la productividad de maíz por hectárea pasó de 975 a 1 770 kilogramos y la de trigo, de 1 417 a 3 480 kilogramos, lo cual constituyó un aporte que alivió en parte los problemas de escasez de alimentos y la desnutrición. Debemos tener presente que se hace necesario un importante apoyo financiero y tecnológico para lograr la generalización de este sistema en todo el país, dado que los problemas del campo siguen siendo muy graves.
Además de las citadas, son varias las instituciones nacionales que realizan investigación de carácter biológico y bioquímico, orientada al reino vegetal: la Facultad de Química de laUNAM, el Centro de Investigación y Estudios Avanzados del IPN de Irapuato y el Centro de Investigación Científica de Yucatán. Parte de la investigación se orienta hacia el mejoramiento de las poblaciones vegetales para obtener mayor resistencia genética a las enfermedades y a las plagas, así como hacia el desarrollo de una mayor tolerancia a la sequía y el almacenamiento. Todo esto es de gran importancia en un país en el que el maíz y el frijol son la base de la alimentación, y donde 80% de la superficie cultivada depende de la lluvia como única fuente de humedad.
UN PROBLEMA GRAVE Y UNA ENORME POTENCIALIDAD
Después de presentar este panorama de la química mexicana, vale la pena resaltar las razones por las que el desarrollo de la ciencia central ha sido tan moderado.
Desde luego, la química comparte con otras ciencias una problemática común de financiamiento y ausencia de tradición, heredadas de nuestra condición de país tercermundista. De aquí se deriva la tragedia de la ciencia mexicana. Sin embargo, esta ciencia presenta una característica muy peculiar, ya que de ella ha derivado una de las industrias más dinámicas de la economía: la industria química. Esto representa una gran ventaja y potencialidad, pero también un grave problema.
Las aplicaciones de la química empezaron a darse aun antes de que ésta se estableciera como ciencia. Por ejemplo, la edad de hierro sólo pudo ocurrir mediante el aprendizaje de la transformación de los minerales en metales, pero ello tuvo lugar milenios antes del nacimiento de Lavoisier y Dalton. Así, el conocimiento empírico se adelantó grandemente al conocimiento científico, el cual es muy reciente. Con ello, mucha gente se contentó con el saber hacer sin importar mucho el saber por qué. Fueron pocos los países donde se utilizó la química para comprender todos esos hechos y técnicas producto de la experiencia acumulada. Muy pronto esos mismos países pudieron acoplar la investigación fundamental con la producción de nuevos bienes. Nosotros importamos la manera de hacerlos, pero no cultivamos ni trasladamos la forma de conocer cómo desarrollar otros.
Así, cuando en México se presentó el fenómeno de la industrialización, la química participó como una actividad técnica (más que científica) modelada por nuestro carácter dependiente. De esta manera, el ejercicio creativo de la química y la ingeniería química se restringió a los espacios académicos universitarios, en franca desconexión con la producción, ya que ésta no necesitaba de creatividad, pues surgió como una actividad refleja.
Este es el gran reto de la química en México: lograr que se realicen nuevos descubrimientos que luego transiten, en el tiempo necesario, de la mesa de laboratorio a la instalación industrial o al campo y de allí se conviertan en beneficio para la población. Es urgente que se deje de concebir a la química como una ciencia «para hacer cosas» y que se piense en ella «para conocer más cosas», que luego nos beneficien más.
Los pocos ejemplos citados deben repetirse con más frecuencia. Pero ello sólo se logrará cuando se adquiera total conciencia de la importancia capital que tiene para un país el desarrollo de la ciencia y de sus aplicaciones originales. Otro será el estado de este país cuando tengamos menos cosas que aprender y más que enseñar. Por ahora, seguimos aprendiendo…o aquí!
