Ácidos
De acuerdo con Arrhenius (1887), un ácido es cualquier sustancia que en disolución acuosa libera iones H+. Un ejemplo es el ácido clorhídrico (HCl):
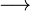 H+ + Cl–
H+ + Cl–En 1923, Bronsted y Lowry propusieron que un ácido es una sustancia capaz de transferir protones (H+). Esta teoría generalizó la de Arrhenius, aplicándose también a disoluciones no acuosas.
Lewis, en 1923, amplió la definición de ácido: una especie química que, en cualquier medio, puede aceptar un par de electrones. Esto incluye sustancias que se comportan como ácidos, pero no cumplen la definición de Bronsted-Lowry, llamados ácidos de Lewis. Dado que el protón (H+) es un ácido de Lewis (tiene un orbital 1s vacío), todos los ácidos de Bronsted-Lowry son ácidos de Lewis, y todos los ácidos de Arrhenius son Bronsted-Lowry.
- Ejemplos de ácidos Bronsted-Lowry: HCl, HNO3, H3PO4 (donan H+ durante la reacción).
- Si están en solución acuosa, también son ácidos de Arrhenius.
Bases
Según Arrhenius, una base (o álcali) es cualquier sustancia que libera iones OH– (hidroxilo) en disolución acuosa. Las bases tienen bajas concentraciones de iones H+ y un pH superior a 7. Tienen sabor astringente y se usan como productos de limpieza, antiácidos, etc. Algunas bases, como el hidróxido de magnesio (leche de magnesia), son débiles. Otras, como el hidróxido de sodio (NaOH o sosa cáustica), son corrosivas.
Bronsted y Lowry (1923) definieron una base como un aceptor de protones (H+).
Lewis definió una base como cualquier sustancia que dona pares de electrones.
Las bases neutralizan los ácidos, formando agua y sal:
- H2SO4 + Ca(OH)2 → 2 H2O + CaSO4 (ácido sulfúrico + hidróxido de calcio = agua + sulfato de calcio)
- HCl + NaOH → H2O + NaCl (ácido clorhídrico + hidróxido de sodio = agua + cloruro de sodio)
Sales
En química, una sal es un compuesto iónico formado por cationes y aniones. Generalmente, son el producto de una reacción química entre:
- Una base y un ácido: forma una sal y agua. Ejemplo: 2 NaOH + H2SO4 → Na2SO4 + 2 H2O
- Un metal y un ácido: forma una sal e hidrógeno. Ejemplo: Mg + H2SO4 → MgSO4 + H2
- Un óxido básico y un ácido: forma una sal. Ejemplo: CO2 + CaO → CaCO3
Los iones que forman las sales pueden ser monoatómicos (ej. F–, Ca2+) o poliatómicos (ej. SO42-), inorgánicos o orgánicos (ej. CH3COO–).
Las sales suelen formar cristales, solubles en agua. Tienen alto punto de fusión, baja dureza y compresibilidad. Conducen la electricidad cuando están fundidas o disueltas en agua.
La sal más común es el cloruro de sodio (NaCl), o sal de mesa.
La neutralización de ácidos por bases puede ser total o parcial, generando sales ácidas o básicas.
Óxidos
Un óxido es un compuesto químico binario formado por oxígeno y otro elemento. Ejemplos: óxido de hierro III (herrumbre), dióxido de carbono (CO2), óxido de calcio (cal).
En los óxidos, el oxígeno es el elemento más electronegativo. Compuestos como OF2 o H2O2 no son óxidos, sino fluoruros de oxígeno, ya que el flúor es más electronegativo que el oxígeno.
