Metales y No Metales
Los metales y no metales son elementos químicos con propiedades físicas y químicas que los caracterizan.
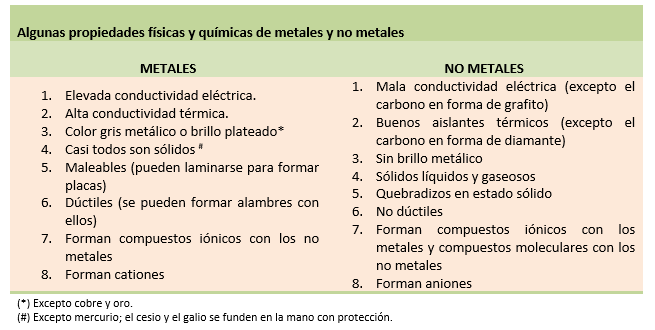
Propiedades Físicas de los Metales y los No Metales
En la siguiente tabla se resumen las propiedades físicas de los metales y no metales:
Carácter Metálico
El carácter metálico tiende a decrecer conforme nos movemos a la derecha en un período (renglón). Esto es equivalente a decir que el carácter no metálico crece al aumentar el valor de la energía de ionización. En cualquier familia (columna), el carácter metálico crece de arriba hacia abajo (los valores de la energía de ionización disminuyen al bajar en la familia).
Esta tendencia general no se observa necesariamente en los metales de transición.
Relación entre la Configuración Electrónica y el Comportamiento Químico
Existe una relación entre la configuración electrónica y el comportamiento químico. La estabilidad de los electrones se refleja en la energía de ionización de los átomos. La energía de ionización es la cantidad de energía requerida para eliminar un electrón de un átomo neutro de un elemento en estado gaseoso. La variación de la energía de ionización está relacionada con el tamaño del átomo y del elemento, y con el valor de su electronegatividad.
Propiedades Periódicas de los Elementos por su Electronegatividad
De acuerdo con L. Pauling, la electronegatividad es «la fuerza con que un átomo, en una molécula, atrae hacia sí los electrones que lo unen con otro átomo». En general, la electronegatividad aumenta de izquierda a derecha a lo largo de un período de la tabla periódica, coincidiendo con la disminución del carácter metálico de los elementos. En cada grupo, la electronegatividad disminuye al aumentar el número atómico y aumenta el carácter metálico. En los metales de transición no se sigue esta tendencia.
El radio atómico de un elemento se puede determinar midiendo la distancia entre los núcleos de dos átomos adyacentes y luego dividiendo esa distancia por dos. Esto a menudo se hace utilizando cristalografía de rayos X u otros métodos espectroscópicos.
En la tabla periódica, el radio atómico generalmente disminuye a medida que vamos de izquierda a derecha a través de un período (debido al aumento de la carga nuclear) y aumenta a medida que nos movemos hacia abajo dentro de un grupo (por el número creciente de capas de electrones).
Reacciones Químicas de Síntesis de Óxidos, Oxiácidos e Hidróxidos
Prácticamente todos los elementos conocidos, metales y no metales, reaccionan o son oxidados por el oxígeno formando óxidos. Así, cuando un metal reacciona con oxígeno se forma su óxido:
metal(s) + oxígeno (g) → óxido metálico(s) ó óxido básico
Por consiguiente, al combinar metales como sodio (Na), magnesio (Mg) o calcio (Ca) con el oxígeno, se produce el óxido de cada uno de ellos:
Oxidación de Sodio
4Na(s) + O2(g) → 2Na2O(s)
Oxidación de Magnesio
2Mg(s) + O2(g) → 2MgO(s)
Oxidación de Calcio
2Ca(s) + O2(g) → 2CaO(s)
Por lo general, los óxidos metálicos son sólidos; algunos son de color blanco, como el óxido de sodio, óxido de magnesio, óxido de calcio y óxido de aluminio, y otros son de color, como el óxido de hierro. El oxígeno reacciona con la mayor parte de los metales formando óxidos. Pero no todos reaccionan igual: metales como el oro, la plata o el platino (llamados metales nobles) no se oxidan al aire libre. Las reacciones de oxidación de metales empiezan lentamente, e incluso puede ser necesario aplicar un calentamiento inicial, como en el caso del magnesio, pero una vez iniciada la reacción hay liberación de energía o incluso incandescencia.
Por otro lado, los no metales también tienen la propiedad de combinarse químicamente con el oxígeno. Cuando se quema un trozo de carbón o una muestra de azufre, estos no metales reaccionan con el oxígeno formando sus óxidos:
no metal + oxígeno (g) → óxido no metálico(g) ó óxido ácido
Por ejemplo, en el caso del carbono se forma el monóxido de carbono (CO) y el dióxido de carbono (CO2), que son gases incoloros e inodoros, pero de características distintas, y en el caso del azufre se forman el dióxido de azufre (SO2) y el trióxido de azufre (SO3), que son gases de olor desagradable.
Ejemplos: Oxidación del Carbono
C(s) + O2(g) → CO2(g)
Por lo general, los óxidos no metálicos son gaseosos, excepto en el caso de la reacción entre el hidrógeno y el oxígeno para formar agua (H2O), que es un líquido a condiciones de presión y temperatura ambiente. Por lo anterior, los metales y los no metales tienen un comportamiento químico diferente cuando los combinamos con oxígeno, y a la reacción que se produce se le conoce con el nombre de oxidación. Este comportamiento es una propiedad característica. Esta reactividad química de los elementos es la causa de que la mayoría de éstos se encuentren combinados formando compuestos.
Óxidos Metálicos y No Metálicos, y su Reacción con Agua
Cuando un óxido metálico se combina con agua y se le agregan unas gotas de indicador universal, adquiere una coloración entre verde y azul. Esta propiedad indica que el producto obtenido tiene un carácter básico y se dice que es un hidróxido o una base. Debido a este comportamiento, a los óxidos metálicos también se les llama óxidos básicos. La expresión general para representar esta reacción es la siguiente:
Óxido básico o metálico(s) + agua (l) → base o hidróxido (ac)
Ejemplos
2MgO(s) + 2H2O (l) → 2Mg(OH)2(ac)
Na2O (s) + H2O (l) → 2NaOH(ac)
Los gases nobles son el grupo de elementos con la mayor energía de ionización en la tabla periódica.
El oxígeno tiene 6 electrones de valencia y necesita compartir dos de sus electrones uniéndose o enlazándose a otro átomo.
La energía de ionización es la energía que se necesita para separar un electrón de un átomo neutro o catión en estado gaseoso.
