SUSTANCIA PURA
| SUSTANCIA PURA Es toda sustancia que tiene su composición química homogénea e invariante. Ejemplo: el agua, el nitrógeno, el oxígeno, el amoníaco y muchos más. La sustancia pura puede presentarse en distintas fases: sólido, líquido y gaseosa. Dependiendo de los valores de presión y temperatura una sustancia puede estar como sólido, líquido o vapor o presentarse en dos o tres fases a la vez. CAMBIOS DE FASEExisten en la naturaleza muchas situaciones en que dos fases de una sustancia pura coexisten en equilibrio. El agua existe como líquido y vapor dentro de una olla de presión. El agua sólida o hielo a la temperatura y presión normales del ambiente comienza su proceso de condensación. A pesar de que todas las fases de las sustancias son importantes, solo se estudiarán las fases líquido y vapor y su mezcla. En el estudio de la sustancia pura se toma como ejemplo el agua por ser una sustancia muy familiar. TEMPERATURA DE SATURACIÓN Y PRESIÓN DE SATURACIÓNLa **temperatura de saturación** y la **presión de saturación** son aquellas en donde ocurre la ebullición de una sustancia pura. Para una presión de saturación existe un único valor de temperatura de saturación y viceversa. Para el agua, a una presión de 101.35 kPa la temperatura de saturación es 100ºC. En sentido inverso, a una temperatura de 100ºC la presión de saturación es 101.35 kPa. La gráfica de Psat contra Tsat da una curva característica para cada sustancia pura y se conoce como **curva de saturación de líquido-vapor**. Figura 1.27. 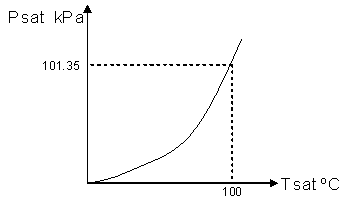 Fig. 1.27 Curva de saturación líquido-vapor de una sustancia pura (los valores numéricos corresponden al agua). En la Figura 1.27 se puede observar que la temperatura de saturación aumenta con un incremento de la presión. Cuando se cocina, las temperaturas de ebullición más altas implican tiempos de cocción más cortos y ahorros de energía. Por ejemplo, cuando se cocina en una olla de presión la temperatura de ebullición es superior a los 100ºC ya que la presión que se consigue en una olla de presión es superior a los 101.35 kPa. En aquellos sitios que se encuentran por encima del nivel del mar, la presión atmosférica disminuye en la medida que se asciende así como la temperatura de saturación por lo que el tiempo de cocción en estos sitios es mayor. DIAGRAMAS DE ESTADO Y DIAGRAMA DE FASELos **diagramas de estado** permiten representar los distintos cambios de estado que experimentan las sustancias. Estos son los diagramas P-v y T-v. El **diagrama de fase** únicamente representa las tres fases para cualquier sustancia. Este es el diagrama P-T. Diagrama T-vEl diagrama T-v se obtiene de la proyección de la superficie PvT (Figura 1.28) en el plano T-v. La proyección resultante sobre un plano paralelo a los ejes T-v se muestra en la Figura 1.29. En este diagrama tanto las regiones de una y dos fases aparecen como áreas. 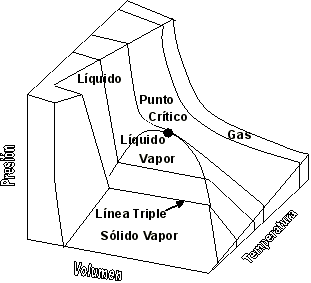 Fig. 1.28 Superficie P-v-T de una sustancia que se expande al congelarse (como el agua). Es común que dos fases estén en equilibrio, pero en algunas condiciones las tres fases de una sustancia pura coexisten en equilibrio. En los diagramas P-v o P-T, estos estados de fase triple forman la **línea triple**. Los estados de una sustancia sobre la línea triple tienen la misma presión y temperatura, pero diferentes volúmenes específicos. La línea triple aparece como un punto sobre los diagramas P-T y, por tanto, suele denominarse **punto triple**. 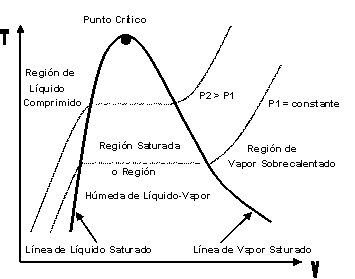 Fig. 1.29 Figura T-v de una sustancia pura. Los estados de líquido saturado en la Figura 1.29 pueden conectarse mediante una línea, **línea de líquido saturado**, y los estados de vapor saturado en la misma figura pueden conectarse mediante la **línea de vapor saturado**. Estas dos líneas se alcanzan en el **punto crítico**, formado un domo como muestra la Figura 1.29. El **punto crítico** se define como el punto al cual los estados de líquido saturado y de vapor saturado son idénticos. La temperatura, la presión y el volumen específico de una sustancia en el punto crítico se denominan, **temperatura crítica Tcr**, **presión crítica Pcr** y **volumen específico crítico vcr**. Las propiedades del punto crítico del agua son Pcr=22.09 Mpa, Tcr=374.14 ºC y vcr=0.003155 m3/kg. Diagrama P-vEl diagrama P-v se obtiene de la proyección de la superficie P-v-T (Figura 1.28) en el plano P-v (Figura 1.30). La forma general del diagrama P-v de una sustancia pura es similar al diagrama T-v, pero las líneas de T=constante sobre este diagrama presentan una tendencia hacia abajo, como muestra la Figura 1.30. Tanto en el diagrama T-v como en el diagrama P-v las regiones de una y dos fases aparecen como áreas. La línea de líquido saturado representa los estados de la sustancia tales que cualquier adición infinitesimal de energía a la sustancia a presión constante cambiará una pequeña fracción de líquido en vapor. De modo semejante, al sustraer energía de la sustancia en cualquier estado que cae dentro de la línea de vapor saturado origina una condensación del vapor, mientras que la adición de energía sobrecalienta al vapor. La región de dos fases, que se denomina líquido y vapor saturados y que queda entre las líneas de líquido saturado y vapor saturado, generalmente se llama **región húmeda** o **bóveda húmeda**. 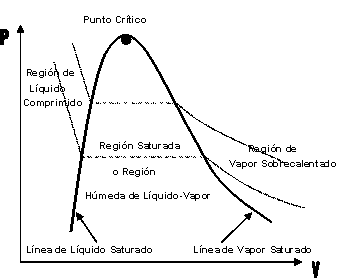 Fig. 1.30 Diagrama P-v de una sustancia pura. Diagrama P-TLa Figura 1.31 muestra el diagrama P-T de una sustancia pura, llamado **diagrama de fase** puesto que las tres fases se separan entre sí mediante tres líneas. 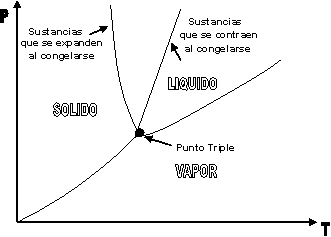 Fig. 1.31 Diagrama P-T de sustancias puras. Resulta de la proyección de la superficie PvT de una sustancia sobre el plano P-T. La **línea de sublimación** separa las regiones sólida y de vapor, la **línea de vaporización** divide las regiones líquida y de vapor, y la **línea de fusión** separa las regiones sólida y líquida. Estas tres líneas convergen en el punto triple, donde las tres fases coexisten en equilibrio. La línea de vaporización finaliza en el punto crítico porque no se pueden distinguir las fases líquida y de vapor arriba del punto crítico. Las sustancias que se expanden y contraen al congelarse difieren solo en la línea de fusión en el diagrama P-T. LA SUPERFICIE P-v-TDesde el punto de vista matemático, cualquier ecuación con dos variables independientes en la forma z=z(x,y) representa en un espacio tridimensional una superficie rectangular, por tanto, es posible representar el comportamiento P-v-T de una sustancia como una superficie en el espacio, como muestra la Figura 1.28. Todos los puntos sobre la superficie representan estados de equilibrio. La totalidad de los estados a lo largo de la trayectoria de un proceso yacen sobre la superficie P-v-T, puesto que tal proceso debe pasar por estados de equilibrio. Las regiones de una fase aparecen como superficies curvas sobre la superficie P-v-T, y las regiones de dos fases como superficies perpendiculares al plano P-T. Era de esperarse puesto que las proyecciones de las regiones de dos fases sobre el plano P-T son líneas. Todos los diagramas bidimensionales vistos hasta ahora, sólo son proyecciones de esta superficie tridimensional sobre los planos apropiados. TABLAS DE PROPIEDADES DE SUSTANCIAS PURASPara la mayoría de las sustancias las relaciones entre las propiedades termodinámicas son demasiado complejas, como para expresarse por medio de ecuaciones simples. Por tanto, las propiedades se presentan en la forma de tablas. Algunas propiedades termodinámicas pueden medirse con finalidad pero con otras no es posible hacerlo de manera directa y se calculan mediante las relaciones que las vinculan con propiedades medibles. Los resultados de estas mediciones y los cálculos se presentan en tablas con un formato conveniente. En el siguiente análisis, se utilizarán **tablas de vapor**, para mostrar el uso de tablas con propiedades termodinámicas. Las tablas de propiedades de otras sustancias se utilizan de la misma manera. Para cada sustancia, las propiedades termodinámicas se listan en más de una tabla. Se prepara una tabla para cada región, como las de vapor sobrecalentado, líquido comprimido y saturada (región húmeda). a) Líquido Saturado y Vapor Saturado: Tablas de SaturaciónEl subíndice f se emplea para denotar propiedades de un líquido saturado y el subíndice g, para las propiedades de vapor saturado. Otro subíndice utilizado es fg, el cual denota la diferencia entre los valores de vapor saturado y líquido saturado de la misma propiedad. Figura 1.29 y 1.30. Ejm, vf : volumen específico del líquido saturado vg : volumen específico del vapor saturado vfg : diferencia entre vg y vf b) Mezcla Saturada de Líquido-VaporEn el proceso de evaporación, una sustancia pasa de su condición de líquido saturado a vapor saturado por lo que la sustancia existe como parte líquida y como parte vapor. Esto es, es una mezcla de líquido y vapor saturados. Figura 1.29 y 1.30. Para analizar esta mezcla de manera apropiada, es necesario conocer las proporciones de las fases líquida y de vapor en la mezcla. Esto se obtiene al definir una propiedad llamada la **calidad _x_** como la razón entre la masa de vapor y la masa total de la mezcla 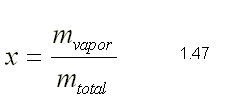 donde 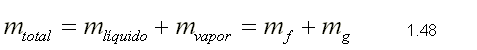 La calidad tiene importancia sólo dentro de la campana. No tiene significado en las regiones de líquido comprimido o vapor sobrecalentado. Su valor se encuentra entre 0 y 1 . Para calcular las propiedades de la sustancia dentro de la región líquido-vapor, se debe conocer el porcentaje de vapor saturado presente en la mezcla líquido-vapor es decir, el valor de la calidad. 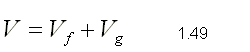 como 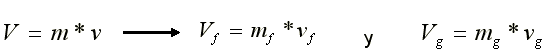 sustituyendo en 1.49 se puede escribir la siguiente expresión: 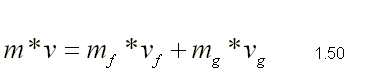 dividiendo por la masa: 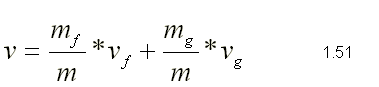 Observe que la relación m g /m representa el porcentaje en masa de vapor saturado en la mezcla y es lo que se conoce como calidad, mientras que la relación m f /m representa el porcentaje en masa de líquido saturado en la mezcla y se denomina humedad, pudiéndose expresar como (1-x). 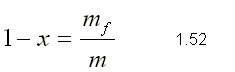 Así, la expresión 1.51 para el volumen específico de la mezcla saturada líquido-vapor, queda de la siguiente forma: Así, la expresión 1.51 para el volumen específico de la mezcla saturada líquido-vapor, queda de la siguiente forma: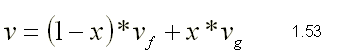 La ecuación 1.53 se puede generalizar para calcular cualquier propiedad específica dentro de la región líquido-vapor: 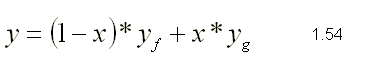 c) Vapor sobrecalentadoEl vapor sobrecalentado se encuentra en la región derecha de la línea de vapor saturado. Figura 1.29 y 1.30. Como la región de sobrecalentamiento es de una sola fase, se necesitan dos propiedades intensivas par fijar o definir el estado de equilibrio. Las tablas de vapor sobrecalentado presentan el volumen específico y otras propiedades específicas como función de la presión y la temperatura. d) Líquido subenfriado o comprimidoEl líquido comprimido se encuentra en la región izquierda de la línea de líquido saturado. Figura 1.29 y 1.30. 0La literatura no ofrece gran cantidad de datos en forma de tablas para los líquidos comprimidos o subenfriados. La variación de las propiedades del líquido comprimido debido a la presión es muy ligera, mientras que con la temperatura muestran mayor dependencia. En la mayoría de los casos, cuando no se dispone de tablas de líquido comprimido para una sustancia pura, los datos sobre el líquido comprimido se pueden aproximar bastante al usar valores de las propiedades del estado líquido saturado a la temperatura dada. Esto implica que los datos del líquido comprimido dependen más de la temperatura que de la presión. 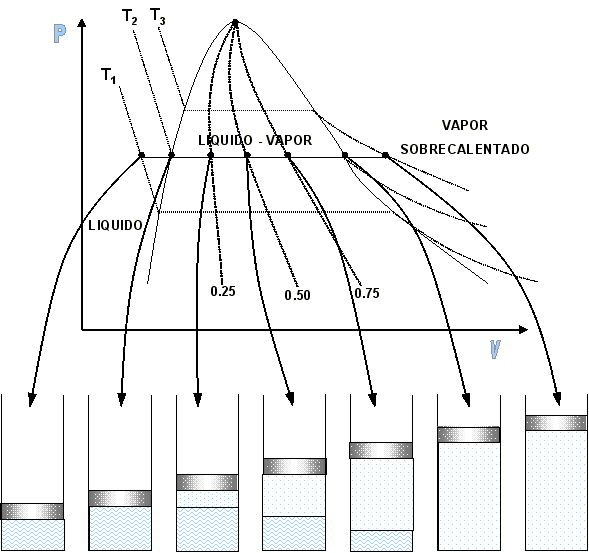 Liquido Comprimido Liquido Mezcla Liquido Vapor Vapor Vapor o Subenfriado Saturado Saturado SobrecalentadoCambio de fase líquida a fase vapor, a presión constante, de una sustancia puraREPRESENTACIONES DE Pv Y DE PTLos diagramas del proceso son una ayuda importante en la resolución de problemas. En la Figura 1.32 se muestran las gráficas para cuatro procesos diferentes en los diagramas Pv y PT
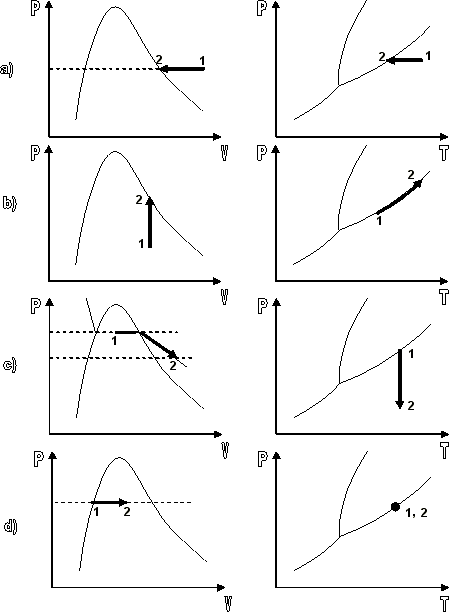 Figura 1.32 Diagrama Pv y PT para los procesos de los ejemplos |
