La Transformación Química
Los cambios que experimentan las sustancias son de dos clases: físicos y químicos. Un cambio físico modifica algunas propiedades de las sustancias sin que se forme otra distinta; sin embargo, un cambio químico supone una modificación profunda de todas las propiedades del cuerpo, lo que determina la aparición de otra distinta. Sin embargo, hay procesos que adquieren una significación intermedia:
- Los cambios químicos suponen modificaciones profundas, mientras que Seguir leyendo “Fundamentos de la Transformación Química: Reacciones, Leyes y Equilibrio” »

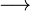 H+ + Cl–
H+ + Cl–